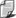 Praca gazu doskonałego
Praca gazu doskonałego
Najłatwiej obliczyć pracę w procesie izochorycznym. Gaz nie zmienia objętości. Ponieważ
DV
= 0 więc pΔV
= 0 czyli
W = 0
W stałej objętości gaz nie wykonuje
więc pracy.
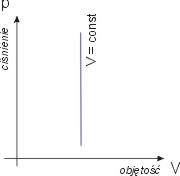
W procesie izobarycznym, czyli pod stałym ciśnieniem, mamy od razu wynik
W = p ΔV
Równanie Clapeyrona daje przy stałym
ciśnieniu pΔV = nR ΔT stąd
W = nR ΔT
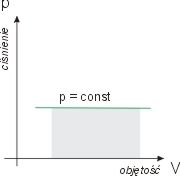
W procesie izotermicznym a więc w stałej temperaturze pole pod krzywą
p = p(V) = nRT/V równe
jest
W = nRT ln( V2/
V1 )
co można (używając prawa Bolyle'a-Mariotte'a)
zapisać
W = nRT ln( p1/
p2 )
W procesie adiabatycznym (bez wymiany ciepła) obliczanie pracy jako
pola pod krzywą ciśnienia daje
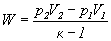
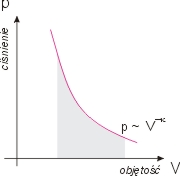
Jak pamiętamy jest tzw. wykładnikiem
adiabaty, równym stosunkowi ciepła molowego
pod stałym ciśnieniem do ciepła molowego
gazu w stałej objętości.
k
= Cp/Cv
Wynik ten można też otrzymać
na podstawie pierwszej zasady termodynamiki
ΔW
= ΔU - ΔQ = ΔU = nCVΔT i równania Clapeyrona, które daje
Δ
(pV) = n R ΔT. Otrzymujemy
W = n CV
ΔT
W = CV
Δ( pV ) / R
W = CV
( p2V2 - p1V1
) / R
Co można przekształcać dalej... |