 Proces izobaryczny
Proces izobaryczny
okreslenie
równanie
stanu: prawo Gay-Lussaca
wykresy
zmiany
energi wewnętrznej
Określenie
Proces izobaryczny to
proces, w którym ciśnienie gazu pozostaje
stałe
p = const
Proces izobaryczny inczej nazywany
jest przemianą izobaryczną lub w skrócie
- izobarą. Jest jednym z izoprocesów
gazu doskonałego
Równanie stanu: prawo Gay –
Lussaca
Stałość ciśnienia pozwala otrzymać
z równania Clapeyrona prostszą postać
równania stanu. Rozważmy w tym celu
proces izobaryczny prowadzący ze stanu
(1) do stanu (2). Napiszmy „dwa”
równania Clapeyrona: dla gazu przed,
i po przeprowadzeniu procesu:
p1V1
= n1RT1
p2V2
= n2RT2
Jest to jednak ten sam gaz, czyli n2
= n1,
a ponadto ciśnienie końcowe równe jest
(z definicji procesu) ciśnieniu początkowemu,
więc p2 = p1.
Opuszczając zbędne indeksy otrzymujemy:
pV1 = nRT1
pV2 = nRT2,
czyli
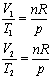
Prawe strony wzorów są sobie równe
a ponadto stałe , więc i lewe strony
muszą być sobie równe. Napiszemy:
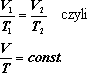
W trakcie przeprowadzania
procesu izobarycznego stosunek objętości
do temperatury jest stały; objętość
i temperatura są w tym procesie wielkościami
proporcjonalnymi.
Otrzymana przez nas zależność stanowi
treść prawa Gay –
Lussaca, uzyskanego pierwotnie na
drodze empirycznej - jako uogólnienie
danych doświadczalnych.
Odejmując stronami równania Clapeyrona,
zauważamy mimochodem, że w tym procesie
pDV
= nRDT
Prawo Gay-Lussaca można wyrazić przy
użyciu innych zmiennych, np. gęstości
r czy koncentracji
a :
Ponieważ r
= m/V, więc V = m/ r.
Po podstawieniu ostatniej zależności
do równania stanu otrzymujemy:
m/rT
= const
rT
= const/m
Masa gazu jest jednak stała –
nie ubywa go ani nie przybywa, więc
ostatecznie
r
T = const
To samo postępowanie daje dla koncentracji
(a = N/V):
aT
= const
Wykresy
 Jeśi V/T = const,
to V = const
· T. Objętość jest
więc liniową funkcją temperatury i wykresem
procesu izochorycznego w zmiennych (V,T)
jest prosta. Wartość współczynnika kierunkowego
tej prostej otrzymujemy wprost z równania
Clapeyrona: Jeśi V/T = const,
to V = const
· T. Objętość jest
więc liniową funkcją temperatury i wykresem
procesu izochorycznego w zmiennych (V,T)
jest prosta. Wartość współczynnika kierunkowego
tej prostej otrzymujemy wprost z równania
Clapeyrona:
V = (nR/p) · T
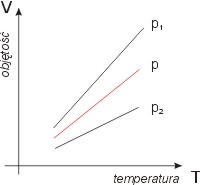
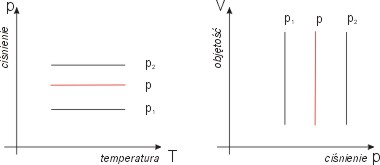
Na rysunku obok widzimy wykres izobary
dla różnych ciśnień, przy czym p1 < p < p2.
Nie doprowadzamy tych prostych do punktu
(T=0, V=0)
wiedząc, że tych warunkach nasz model
- gaz doskonały - nie opisuje rzeczywistości.
W pozostałych zmiennych wykres izobary
nie wymaga komentarza. Jest nim prosta
prostopadła do osi ciśnienia (p = const):
Zmiany energii wewnętrznej
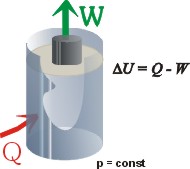 W procesie izobarycznym (pod stałym
ciśnieniem) wyrażenie na pracę wykonaną
przez gaz jest szczególnie proste: W procesie izobarycznym (pod stałym
ciśnieniem) wyrażenie na pracę wykonaną
przez gaz jest szczególnie proste:
DW
= pDV
co (jak pokazaliśmy wyżej rozważając
równanie stanu) jest równoważne
DW
= nR DT
Ciepło pobrane przez gaz dane jest
przez
DQ
= nCP DT
lub, używając ciepła właściwego
DQ
=mcP DT
przy czym pamiętamy, że ciepło molowe
gazu doskonałego w procesie izobarycznym
równe jest
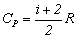
gdzie i oznacza
tzw. liczbę stopni swobody cząsteczki
gazu.
Pierwsza zasada termodynamiki daje
więc na przykład:
DU
= DQ + DW
=
= nCPDT
- p DV = nCPDT - nRDT = n (CP-R)DT
a po uwzględnieniu, że CP-R
= CV
DU
= nCVDT
czyli tak, jak samo jak w przypadku
izochory. Czy wiesz dlaczego?
Można też uzyskać np.:
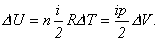
|