 Proces izochoryczny
Proces izochoryczny
okreslenie
równanie
stanu: prawo Charlesa
wykresy
zmiany
energi wewnętrznej
uwagi
Określenie
Proces izochoryczny
to proces, w którym objętość gazu pozostaje
stała
V = const
Proces izochoryczny inczej nazywany
jest przemianą izochoryczną lub w skrócie
- izochorą. Jest jednym z izoprocesów
gazu doskonałego
Równanie stanu: prawo Charlesa
W procesie tym zmieniać sie mogą jedynie
ciśnienie i temperatura gazu. Stałość
objętości pozwala otrzymać z równania
Clapeyrona prostszą postać równania
stanu. Napiszmy je:
pV = nRT
I przekształćmy do postaci:
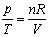
Prawa strona równania zawiera iloczyn
stałej gazowej R, ilości moli gazu (nie
zmienia się) i objętości – która
jest w tym procesie stała z definicji.
Skoro prawa strona równania jest stałą
więc i lewa musi mieć stałą wartość.
Napiszemy:
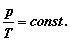
Widzimy, że w trakcie
przeprowadzania procesu izochorycznego
stosunek cisnienia do temperatury jest
stały; cisnienie i temperatura są w
tym procesie wielkościami proporcjonalnymi. Dla dowolnych stanów (1) i (2)
podczas przeprowadzania procesu, na
przykład dla stanu poczatkowego i końcowego
mamy:
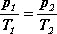
Otrzymana przez nas zależność stanowi
treść prawa Charlesa,
uzyskanego pierwotnie na drodze empirycznej
- jako uogólnienie danych doświadczalnych.
Odejmując stronami równania Clapeyrona
dla gazu przed procesem p1V
= nRT1 i po
procesie p2V
= nRT2, zauważamy
mimochodem, że w tym procesie
(Dp)V
= nRDT
Ponieważ objętoć w procesie izochorycznym
nie zmienia się, więc nie zmieniaj się
również gęstoć gazu r = m/V i koncentracja czsteczek a=
N/V:
r
= const, a = const
Wykresy
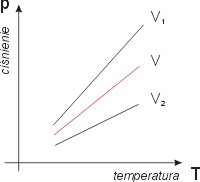 Jeśi p/T = const,
to p = const
· T. Ciśnienie
jest więc liniową funkcją temperatury
i wykresem procesu izochorycznego w
zmiennych (p,T) jest prosta. Wartość
współczynnika kierunkowego tej prostej
otrzymujemy wprost z równania Clapeyrona: Jeśi p/T = const,
to p = const
· T. Ciśnienie
jest więc liniową funkcją temperatury
i wykresem procesu izochorycznego w
zmiennych (p,T) jest prosta. Wartość
współczynnika kierunkowego tej prostej
otrzymujemy wprost z równania Clapeyrona:
p = (nR/V) · T
Na rysunku obok widzimy wykres izochory
dla różnych cobjętości, przy czym V1 < V < V2.
Nie doprowadzamy tych prostych do punktu
(T=0, p=0)
wiedząc, że tych warunkach nasz model
- gaz doskonały - nie opisuje rzeczywistości.
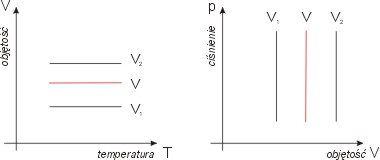
W pozostałych zmiennych wykres izobary
nie wymaga komentarza. Jest nim prosta
prostopadła do osi objętości (V = const):
Zmiany energii wewnętrznej
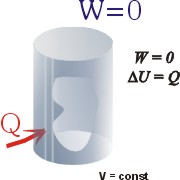 W procesie izochorycznym (w stałej objętości) gaz nie
rozpręża się, nie przesuwa ścianek ani
tłoków, nie wykonuje więc pracy: W procesie izochorycznym (w stałej objętości) gaz nie
rozpręża się, nie przesuwa ścianek ani
tłoków, nie wykonuje więc pracy:
DW
= 0
Ciepło pobrane przez gaz dane jest
przez
DQ
= nCV DT
lub, używając ciepła właściwego
DQ
=mcV DT
przy czym pamiętamy, że ciepło molowe
gazu doskonałego w procesie izochorycznym
równe jest
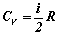
Ponieważ zmiany energii wewnętrznej
dokonują się tu jedynie na drodze cieplnej,
więc pierwsza zasada termodynamiki przybiera
postać:
DU
= DQ
DU
= nCV DT
Uwagi
Do doświadczalnego określenia równania
stanu służy w szkole termometr gazowy
o stałej objętości. |