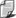 Proces izotermiczny
Proces izotermiczny
okreslenie
równanie
stanu: prawo Boyle'a - Mariotte'a
wykresy
zmiany
energi wewnętrznej
uwagi
Określenie
Proces izotermiczny to proces,
w którym temperatura gazu pozostaje
stała
T = const
Proces izotermiczny inaczej nazywany
jest przemianą izotermiczną lub w skrócie
- izotermą. Jest jednym z izoprocesów
gazu doskonałego
Równanie stanu: prawo Boyle'a - Mariotte'a
Parametrami mogącymi się zmieniać w
tym procesie są objętość V i ciśnieniep. Nie mogą one się
jednak zmieniać niezależnie. Stałość
temperatury pozwala otrzymać z równania
Clapeyrona prostszą postać równania
stanu. Rozważmy w tym celu proces izotermiczny
prowadzący ze stanu (1) do stanu (2).
Napiszmy „dwa” równania
Clapeyrona: dla gazu przed, i po przeprowadzeniu
procesu:
p1V1
= n1RT1
p2V2
= n2RT2
Jest to jednak ta sama ilość gazu,
nie pozwalamy na ucieczkę cząsteczek
ani nie wprowadzamy nowych, więc n2
= n1
, a ponadto temperatura końcowa T2równa jest (z definicji procesu) temperaturze
początkowej T1,
więc T2 = T1. Opuszczając zbędne indeksy
przy n i T
otrzymujemy:
p1V1
= nRT
p2V2
= nRT
Prawe strony wzorów są sobie równe
a ponadto stałe, więc i lewe strony
muszą być sobie równe. Napiszemy:
p1V1
= p2V2
Ponieważ stany (1) i (2) mogą być dowolnymi
stanami podczas procesu, wnioskujemy
że
pV = const.
A więc w trakcie przeprowadzania
procesu izotermicznego iloczyn ciśnienia
i objętości jest stały; ciśnienie i
temperatura są w tym procesie wielkościami
odwrotnie proporcjonalnymi.
Otrzymane przez nas zależności stanowią
treść prawa Boyle’e
– Mariotte’a, uzyskanego
pierwotnie na drodze empirycznej - jako
uogólnienie danych doświadczalnych.
Prawo Boyle'e-Mariotte'a można wyrazić
przy użyciu innych zmiennych, np. gęstości
czy koncentracji:
Ponieważ gęstośćr
= m/V, więc V
= m/r. Po
podstawieniu ostatniej zależności do
równania stanu otrzymujemy:
pm/r
= const.
p/r
= const/m
Masa gazu jest jednak również stała
– nie ubywa go ani nie przybywa,
więc ostatecznie
p/r
= const
To samo postępowanie daje dla koncentracji
(a= N/V)
p/a
= const.
Wykresy
Równanie stanu pV = const
daje:
p = const / V =
(nRT) / V
Określa to zależność ciśnienia od objętości.
Wykresem procesu izotermicznego w zmiennych
(p,V) jest hiperbola. Asymptotami tej
hiperboli są proste p=0
i V=0.
Na rysunku obok widzimy wykres izotermy
dla różnych temperatur, przy czym T1 < T < T2.
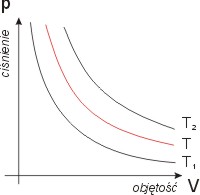
W pozostałych zmiennych wykres izotermy
nie wymaga komentarza. Jest nim prosta
prostopadła do osi temperatury (T =
const):
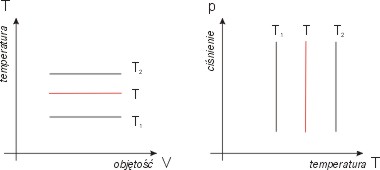
Zmiany energii wewnętrznej
W procesie izotermicznym temperatura gazu
nie zmienia się, a ponieważ energia
wewnętrzna gazu doskonałego zależy wyłącznie
od temperatury, więc w
procesie izotermicznym energia wewnętrzna
gazu doskonałego nie zmienia się
U = const .
czyli DU
= 0
Pierwsza zasada termodynamiki daje:
DU = DQ + DW
= 0, zatem
|D
Q| = |DW|
Zmiany energii wewnętrznej zachodzące
na drodze wykonania pracy i przekazu
ciepła
- równoważą się. Sprężając gaz
w stałej temperaturze, wykonujemy nad
nim wprawdzie pewna pracę,
jednak ta
sama ilość energii wewnętrznej oddawana
jest przez gaz w postaci ciepła. Podobnie
gaz
rozprężając się izotermicznie wykonuje
pracę kosztem pobranego z otoczenia
ciepła.
Aby przeprowadzić proces izotermicznego
sprężania (rozprężania) gazu musimy
zapewnić możliwość
oddania (pobrania)
przez gaz pewnej ilości ciepła. Nie
da się go przeprowadzić ani w układzie
izolowanym termicznie, ani też zbyt
szybko.
W rzeczywistości często przeprowadzając
"proces izotermiczny" najpierw sprężamy
gaz adiabatycznie
a potem pozwalamy
na wyrównanie temperatury. Nie zmienia
to w żadnym razie słuszności prawa
Boyle'e-Mariotte'a
dla stanu początkowego i końcowego takiego
procesu.
Twierdzenie, że praca praca
wykonana jest przez gaz kosztem tej
samej ilości pobranego ciepła
może się
wydać sprzecznym z II zasadą termodynamiki
w sformułowaniu Clausiusa.
Mamy tu bowiem
do czynienia z procesem, w którym całe
pobrane ciepło jest bez strat zamieniane
na pracę. Owa zamiana nie jest jednak
jedynym skutkiem tego procesu: gaz zmienia
swoja objętość.
Obliczenie wartości pracy
(a tym samym równego jej ciepła) jest
proste, wymaga jednak znajomości
rachunku
całkowego. Prowadzi do funkcji logarytmicznej:
DW
= nRTln( V2/ V1
)
Uwagi
Do doświadczalnego określenia równania
stanu służy w szkole pokaz z rurką Meldego. |