 Gaz doskonały
Gaz doskonały
mikroskopowa
i makroskopowa
gazu doskonałego
równanie
stanu - równanie Clapeyrona,
energia
wewnętrzna
granice
stosowalności modelu.
Gaz doskonały definiować można zarówno
na poziomie mikroskopowym (przez podanie
właściwości elementów, z których jest
zbudowany), jak i na poziomie makroskopowym
(poprzez podanie jego właściwości jako
całości). Poniżej podamy obie te definicje
Definicja mikroskopowa
- Gaz składa się z cząsteczek,
które traktować można jak punkty materialne.
Łączna objętość wszystkich cząsteczek
gazu jest więc pomijalna. Zależnie
od rodzaju gazu, cząsteczka może być
atomem lub związana grupą atomów.
Z punktu widzenia chemii cząsteczki
gazu to cząsteczki pierwiastka lub
związku chemicznego. Wszystkie one
są identyczne.
- Cząsteczki podlegają prawom mechaniki
Newtona.
- Całkowita liczba cząsteczek jest
bardzo duża. Cząsteczki poruszają
się chaotycznie we wszystkich kierunkach,
zderzają ze ściankami naczynia i ze
sobą nawzajem. Niezależnie od losów
poszczególnych cząsteczek, o zachowaniu
gazu w skali makro decydują średnie
wartości całego zespołu.
- Cząsteczki zdarzają się ze sobą
sprężyście, wymieniają pęd bez strat
energii.
- Poza momentami zderzeń cząsteczki
nie oddziałują ze sobą, a czas trwania
tych zderzeń jest pomijalnie mały.
Zakładamy tym samym mały - w porównaniu
z rozmiarami cząsteczek - zasięg sił
oddziaływania międzycząsteczkowego.
Znaczy to też że pomiędzy zderzeniami
cząsteczki poruszają się ruchem jednostajnym
prostoliniowym.
Definicja mikroskopowa określa więc
gaz doskonały jako zespół cząsteczek
o szczególnych własnościach. Podane
tu elementy definicji są punktem wyjścia
kinetycznej teorii gazu.
Definicja makroskopowa (termodynamiczna)
Za gaz doskonały uważać będziemy gaz
spełniający łącznie prawa Boyle'a-Mariotte'a,
Gay-Luusaca i Charlesa, czyli gaz dla
którego w stałej temperaturze iloczyn
objętość i ciśnienie są odwrotnie proporcjonalne,
dla określonej objętości ma stały stosunek
ciśnienia do temperatury jest stały,
a pod stałym ciśnieniem - proporcjonalne
są objętość i temperatura. Łącznie możemy
to zapisać jedną zależnością:
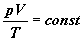
Powyższy związek, definiujący gaz doskonały
w ujęciu makroskopowym dotyczy oczywiście
ustalonej ilości materii (ustalona masa,
ustalona liczba cząsteczek, ustalona
liczba moli gazu)
Definicja ta określa związek pomiędzy
parametrami termodynamicznymi gazu -
a więc określa gaz doskonały poprzez
jego równanie stanu.
Równanie stanu - równanie Clapeyrona
Pełna postać równania stanu gazu
doskonałego jest następująca:
p V = n R T
i nazywane jest ono równaniem
Clapeyrona. Przy czym p oznacza
ciśnienie gazu, V
- objetość, T - temperaturę, n - liczbę moli
gazu a R jest
tzw. stałą gazową równą R = 8, 314 J/mol·K.
Nic nie przeszkodzi, używając związku
R = NA k
zapisać równania następująco:
p V = N k T
gdzie k = R / NA jest stałą Boltzmanna
Na uwagę zasługuje fakt, że wymiarem
prawej (i lewej) strony jest wymiar
energii.
Równanie stanu w innych zmiennych
Równanie Clapeyrona wiąże ze sobą występujące
w nim wielkości, lecz można wyrazić
je w innych zmiennych. Pamiętając, że
gęstość r = m/V, a masa m
= nm ,
gdzie m oznacza
masę jednego mola otrzymujemy r
= nm/V
czyli V = nm/r , .a
po wstawieniu tak wyrażonej objętości
do równania stanu mamy jego równoważną
postać:
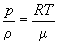 . .
Można też użyć koncentracji cząstek
a = N/V. Objętość możemy zapisać jako V
= N/a.
Ponadto liczba moli n
= N/NA , wiec równanie
stanu przybiera postać:
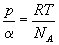
Obydwie powyższe postacie wiążą ze
sobą wyłącznie wielkości intensywne
i maja charakter "lokalny". O powiązanie
ze sobą wielkości ekstensywnych pokusimy
się kiedy indziej, używając pojęcia
entropii
Użyteczna zależność
Przeprowadzając dowolny proces z udziałem
stałej ilości gazu doskonałego możemy
napisać równanie Clapeyrona dla stanu
początkowego (1) i końcowego (2):
p1 V1
= n R T1
p2 V2
= n R T2
a po odjęciu stronami pierwszego od
drugiego otrzymujemy
p2V2
- p1V1 = n R (
T2 - T1 )
czyli
D
(pV) = n R DT
Energia wewnętrzna gazu doskonałego
Poszukując wyrażenia na energię wewnętrzną
gazu doskonałego zauważmy najpierw,
że - zgodnie z wynikami
teorii kinetycznej energia wewnętrzna gazu doskonałego zależy wyłącznie od temperatury
gazu, tzn. dla określonej masy gazu
jest jednakowa dla wszystkich stanów
gazu o jednakowej temperaturze.
Wyrażenie na energię wewnętrzną gazu
doskonałego otrzymamy analizując ogrzewanie
gazu w stałej objętości, bo to najprostsze.
Gaz nie wykonuje wówczas pracy DW
= p DV = 0. Pierwsza zasada termodynamiki
daje DU
= DQ
+ DW = DQ + 0, czyli DU
= DQ.
Zastosowanie definicyjnego wzoru na
ciepło molowe prowadzi do:
DU
= n CV DT
co - używając równania Clapeyrona
- da się zapisać w postaci:
DU
= CV D( pV ) / R
DU
= CV ( p2V2
- p1V1 )
/ R
Zależność ta - podkreślmy - jest słuszna
nie tylko dla izochory, lecz dla dowolnego
procesu stałej masy gazu, w którym temperatura
zmienia się o DT
.
Zmiana energii wewnętrznej w wybranym
przez nas procesie o stałej objętości
(a-A) jest taka sama jak w procesie
przebiegającym pod stałym ciśnieniem
(a-B), taka jak w procesie adiabatycznym
(b-A) i w ogóle taka sama dla wszystkich
procesów prowadzących od temperatury
T1do T2.
Przyjmują za temperaturę początkową
T = 0 K możemy
to zapisać:
U - U0 = n CV
T ,
czyli
U = n CV
T + U0
,
gdzie U0 jest stałą równą
wartości energii wewnętrznej w temperaturze
0K. Rozsądnie jest przyjąć ją równą
zeru.Otrzymujemy ogólny wzór na
energię wewnętrzną gazu doskonałego:
U = n CV
T
Granice stosowalności modelu
Jak każdy model rzeczywistości - tak
i gaz doskonały podlega pewnym ograniczeniom
i w pewnych warunkach przestaje się
sprawdzać. O ile w normalnych warunkach
model gazu doskonałego pozwala uzyskiwać
wyniki zbliżone do doświadczalnych (dla
większości gazów), o tyle zawodzi zdecydowanie
dla niskich temperatur i dużych gęstości,
nie przewidując zmian stanu skupienia
(skraplanie). |