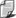 Gazy rzeczywiste
Gazy rzeczywiste
równanie Van
der Waalsa
inne równania
dwuparametrowe
Gazy doskonałe nie istnieją.
Model, jakim jest gaz doskonały, pozwala
na proste rachunki i sprawdza się dość
dobrze w pewnych warunkach. Jednak cierpi
braki zarówno co do realizmu założeń,
jak i co do opisu zachowania się gazów.
Założenia, które posłużyły do budowy
modelu gazu doskonałego w pewnych warunkach
tracą sensowność. Postulat zerowej objętości
cząsteczek gazu nie daje się obronić,
podobnie jak założenie że cząsteczki
nie oddziałują ze sobą. W efekcie
model gazu doskonałego nie opisuje poprawnie
rzeczywistości. Wartości doświadczalne
odbiegają od przewidywań teorii.
Co gorsza, poza niedociągnięciami ilościowymi,
model ten ponosi klęskę jakościową.
Zawodzi całkowicie w tych warunkach,
gdzie objętości cząsteczek staje się
porównywalna z objętością zajmowana
przez gaz (gdy na skutek koncentracji
cząsteczek odległości między nimi stają
się porównywalne z ich rozmiarami).
Według równania Clapeyrona w temperaturze
dążącej do zera bezwzględnego objętość
gazu pod stałym ciśnieniem malałaby
do zera. Tak się jednak nie dzieje,
bo gaz najczęściej w takich warunkach
nie jest już gazem... Mówimy tu
o przejściach fazowych (skraplanie gazu
w niskich temperaturach i wysokich ciśnieniach),
których to przejść model wcale nie przewiduje.
Zbudowano więc modele pozwalające -
przynajmniej częściowo - uwzględnić
takie fakty jak niezerowa objętość cząsteczek
gazu i istnienie oddziaływań między
cząsteczkami. Są one dobrym przybliżeniem
rzeczywistości w szerszym zakresie ciśnień
i temperatur, choć nie znamy równania
słusznego dla każdego gazu w każdych
warunkach. Poniżej kilka najbardziej
popularnych równań stanu:
Równanie Van der Waalsa
Ma ono postać
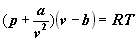
gdzie
p jest ciśnieniem
gazu,
v jest objętością molową v = V/n
lub po prostu objętością jednego mola
gazu,
R to uniwersalna stała
gazowa,
T jest temperaturą
bezwzględną (mierzoną w kelwinach),
natomiast a i b to stałe, wyznaczane zresztą na drodze doświadczalnej dla
każdego gazu.
Jak widać, do równania Clapeyrona,
zapisanego przy użyciu objętości molowej
pv = RT
wprowadzone zostały poprawki - poprawka
do ciśnienia (+ a/V2
) i poprawka do objętości (-
b).
Poprawka do ciśnienia ma odzwierciedlać
przyciąganie między cząsteczkami gazu
dla większych odległości.
Poprawka do objętości to próba uwzględnienia
objętości własnej cząsteczek gazu (ściślej
mówiąc - sił odpychania na małych odległościach).
Gaz opisywany tym równaniem nazywany
bywa gazem Van der Waalsa. Sukcesem
tego modelu jest to, że daje pewne wskazówki
co do przejść fazowych (skraplanie gazu)
i postuluje nieściśliwość cieczy (nieskończony
wzrost ciśnienia dla objętości gazu
zbliżającej się do objętości własnej
cząsteczek).
Oczywiście możemy również użyć
"zwykłej" objętości. Podstawiając
zależność v = V/n
trzymamy:
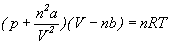
Wartości stałych a
i b można uzyskać
dopasowując krzywe doświadczalne lub
z wartości tzw. parametrów krytycznych
gazu:
Inne równania dwuparametrowe
Wychodzącym z użycia dwuparametrowym
równaniem jest prosta modyfikacja równania
Van der Waalsa - równanie Berthelota:
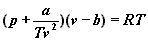
Jest ono dokładniejsze od równania
Van der Waalsa dzięki uwzględnieniu
faktu, że poprawka ciśnienia (+
a/TV2 ) maleje wraz ze
wzrostem temperatury. Jest tak dlatego,
że energia potencjalna dalekich oddziaływań
cząsteczek jest wtedy znikomo mała w
porównaniu z energią kinetyczną cząstek.
Dokładniejszym równaniem, bodaj najlepszym
spośród równań o dwu parametrach jest
równanie Redlich-Kwonga.
Ma ono postać
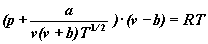
czyli - inaczej pisząc
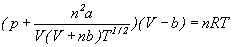
przy czym, podobnie jak w równaniu
Van der Waalsa
p jest ciśnieniem gazu,
v jest objętością
molową v = V/n
lub po prostu objętością jednego mola
gazu,
R to uniwersalna stała
gazowa,
T jest temperaturą
bezwzględną (mierzoną w kelwinach),
natomiast a i b
to stałe, lecz różne od stałych z równania
Van der Waalsa.
Używane bywa również dwuparametrowe
równanie Dietericiego:
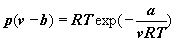
i wiele innych. |