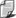 Kinetyczna teoria gazu doskonałego
Kinetyczna teoria gazu doskonałego
czym jest teoria
kinetyczna,
ciśnienie gazu a kinematyka cząsteczek
temperatura gazu, interpretacja
kinetyczna,
energia wewnętrzna i ciepło właściwe gazu jednoatomowego
zasada ekwipartycji energii
energia wewnętrzna i ciepło właściwe gazów wieloatomowych
Czym jest teoria kinetyczna gazu
Teoria kinetyczna gazu (nazywana też
teorią kinetyczno-molekularną albo kinetyczno-cząsteczkową)
jest efektem zastosowania zasad dynamiki
i prostych technik uśredniania do układu
cząsteczek określonego w mikroskopowej
definicji gazu doskonałego. Jest
pierwotną i okrojona wersja mechaniki
statystycznej. Pozwala łączyć kinematyczne
wielkości dotyczące pojedynczych cząstek
gazu z termodynamicznymi parametrami
takimi jak ciśnienie czy temperatura.
Rozwinęli ją m.in. R.Boyle, D.Bernoulli,
R.Clausius i C.Maxwell.
Ciśnienie gazu według teorii kinetycznej
Gaz - zgodnie z przyjętym modelem -
to zespół wielu cząsteczek - punktów
materialnych poruszających się chaotycznie.
Cząsteczki te zderzają się ze sobą.
Zderzają się też ze ściankami naczynia
i te właśnie zderzenia są dla
nas szczególnie interesujące. W trakcie
zderzeń ze ściankami zmienia się wektor
prędkości cząsteczek. Zgodnie z drugą
zasadą dynamiki F
= m (Dv/Dt) do zmiany prędkości
ciała potrzebna jest siła. W tym przypadku
jest to siła z jaką ścianka działa na
cząsteczkę podczas zderzenia. A skoro
ścianka działa na cząsteczki gazu, to,
zgodnie z trzecia zasadą dynamiki, cząsteczki
gazu oddziałują pewna siłą na ścianki.
Widzimy wiec, że na poziomie mikroskopowym
za ciśnienie gazu wywierane na ścianki
naczynia odpowiedzialne jest oddziaływanie
cząsteczek gazu ze ściankami podczas
zderzeń.
Ścisła zależność jest następująca:
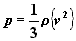
gdzie {v2}
oznacza średnią w całym zespole wartość
kwadratu prędkości cząstki a r
jest gęstością gazu.
Inną popularne postacie tego wzoru
otrzymujemy pamiętając, że np. r
= masa/objętość , a z
kolei masa gazu toM = nm/V ( m
oznacza masę jednego mola gazu, a n
to ilość moli).
pV = 1/3nm{v2}
Można teżzapisać masą jako M
= N m - ilość cząsteczek pomnożoną
przez masę cząsteczki.
Daje to:
pV = 1/3Nm{v2}
Iloczyn masy cząsteczki i kwadratu prędkości
prowadzi do pojęcia energii kinetycznej.
Wzór można więc zapisać jako:
pV = 2/3N{Ek}
Oczywiście {Ek}=
1/2 m {v2} oznacza
średnią wartość energii kinetycznej
cząsteczek gazu.
Niekiedy mówi się też o tzw. średniej
prędkości kwadratowej, określanej jako
pierwiastek ze średniego kwadratu prędkości:
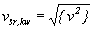
Jest ona większa od prędkości średniej,
może być jednak używana do zgrubnego
oszacowania średniej prędkości cząsteczek
w gazie. Na podstawie podanego powyżej
związku mamy
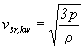
Kinetyczna interpretacja temperatury
gazu
Znajomość wyprowadzonego powyżej wzoru
na ciśnienie gazu pozwala na podanie
kinetycznej interpretacji temperatury.
Łącząc zależność
pV = 2/3 N {Ek}
z równaniem Clapeyrona pV
= NkT otrzymujemy
NkT = 2/3 N {Ek}
czyli
{Ek} = 3/2
k T
Widać więc że temperatura
jest niczym innym jak miarą średniej
energii kinetycznej cząsteczek gazu
i że energia cząsteczek gazu zależy
wyłącznie od temperatury.
Jest to podstawowy wynik kinetycznej
teorii gazu doskonałego. Pamiętając,
że {Ek}=
1/2 m {v2}, możemy
z powyższego związku otrzymać "termiczną"
postać wzoru na średnią prędkość kwadratową:
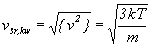 . .
Ten ciekawy rezultat wiąże wprost prędkość
cząsteczek z temperaturą i masą. Dla
gazu składającego się z cząsteczek o
różnych masach, w danej temperaturze
większe prędkości (oczywiście biorąc
pod uwagę wartości średnie) będą miały
cząsteczki o mniejszej masie. Tym właśnie
tłumaczymy nieobecność wodoru w ziemskiej
atmosferze. Cząsteczki wodoru, jako
najmniej masywne, miały największe prędkości,
w szczególności często większe od drugiej
prędkości kosmicznej (prędkość ucieczki)
co spowodowało ich odpływ w przestrzeń
kosmiczną.
Różnicowanie prędkości w zależności
od masy jest też podstawą rozdzielania
izotopów. Cząsteczki zawierające lżejsze
jądra szybciej dyfundują. Wielokrotnie
powtarzany proces dyfuzji przez porowate
przegrody prowadzi do wyselekcjonowania
cząstek różniących się masą. Tak np.
prowadzi się proces wzbogacania uranu.
Energia wewnętrzna i ciepło molowe
- gaz jednoatomowy
Energią wewnętrzną nazywamy całkowitą
energię związaną z chaotycznym ruchem
cząsteczek ciała oraz z ich wzajemnymi
oddziaływaniami. W przyjętym przez nas
modelu (gaz doskonały) cząsteczki ze
sobą nie oddziałują na odległość, nie
ma żadnej energii potencjalnej związanej
z ich wzajemnym oddziaływaniem, stąd
cała wewnętrzna energia gazu sprowadza
się do energii kinetycznej. Skoro (średnio
rzecz biorąc) energia kinetyczna jednej
cząsteczki równa jest Ek = 3/2 kT, to dla całego zespołu
N cząsteczek
mamy
U = N Ek = 3/2 NkT =
3/2 nRT
Jak widać - energia wewnętrzna
gazu doskonałego jest zależna wyłącznie
od temperatury gazu i do niej proporcjonalna.
Porównując z: U =
nCvT łatwo otrzymamy
wzór określający ciepło molowe gazu
w stałej objętości
Cv = 3/2
R
Cp = Cv
+ R = 5/2 R
k
= Cp/Cv = 5/3
Zasada ekwipartycji energii
Wynik E = 3/2 kT
otrzymany dla gazu jednoatomowego nie
opisuje poprawnie gazu o bardziej złożonych
cząsteczkach. W przypadku gazu składającego
się z cząsteczek rozumianych jako
nie związane ze sobą punkty materialne
jedyna możliwa do pomyślenia energia
to energia kinetyczna ruchu postępowego.
Rozszerzając nieco nasz model możemy
wyobrazić sobie budulec gazu nie jako
punkty, lecz dwu lub wieloatomowe cząsteczki.
Takie cząsteczki mogą wykonywać również
obroty, a atomy w cząsteczkach mogą
wykonywać oscylacje wokół położenia
równowagi.Każdą z tych możliwości
(liczymy tylko niezależne od siebie)
- nazywamy stopniem swobody. Dla cząsteczki
rozumianej jako punktu materialnego
mamy trzy niezależne możliwe ruchy -
trzy stopnie swobody. Są to ruchy postępowe
wzdłuż trzech prostopadłych osi. Każdy
z tych ruchów może wykonywać cząsteczka
niezależnie od pozostałych.
Zasada ekwipartycji energii głosi,
że w wielocząsteczkowym zespole, jakim
jest gaz średnia energia
przypadająca na każdy stopień swobody
jest taka sama.
Skoro, jak obliczyliśmy, na trzy stopnie
swobody cząsteczki punktowej przypada
łącznie E = 3/2kT,
to łatwo zauważyć, że energia przypadającą
na jeden stopie swobody równa jest:
Est sw =
1/2 kT
Energia wewnętrzna i ciepło molowe
- gaz wieloatomowy
W świetle tego co zostało powiedziano
wyżej energia cząsteczki gazu o
i
stopniach swobody jest równa
E = i Est sw = i/2 kT ,
a energia wewnętrzna gazu złożonego
z N cząsteczek gazu
o i stopniach swobody
jest równa
U = N i Est sw.
U = i/2 NkT = i/2nRT
Ciepła molowe i wykładnik adiabaty
wynoszą więc odpowiednio
Cv = i/2
R
Cp = Cv
+ R = (i+2)/2 R
k
= Cp/Cv = (i+2)/i
Wystarczy teraz przeliczyć stopnie
swobody różnych cząsteczek. Dla gazu
jednoatomowego mamy i
= 3 (trzy niezależne ruchy postępowe)
a co za tym idzie Cv = 1/2
R, Cp = 3/2 R, k
= Cp/Cv = 3/2
=1,67.
Dla gazu o cząsteczce dwuatomowej i
= 5 (trzy ruchy postępowe
i dwa obroty wokół osi prostopadłych
do osi cząsteczki), co daje Cv = 5/2 R,
Cp = 7/2 R, k
= Cp/Cv = 7/5
= 1,40.
Dla pozostałych gazów o bardziej złożonych
cząsteczkach i = 6 (trzy ruchy postępowe i trzy obroty) i Cv
= 3 R, Cp = 4 R,
k = Cp/Cv = 4/3 = 1,33.
W rzeczywistości obraz jest bardziej
złożony. Kolejne stopnie swobody (w
tym oscylacje) włączają się wraz ze
wzrostem temperatury i w różnych przedziałach
temperatur ciepła molowe przybierają
różną wartość. |