Rozwój poglądów na budowę
materii
Już w V wieku p.n.e grecki filozof Demokryt zakładał,
że wszelka materia składa się z niepodzielnych i
niezmiennych cząstek - atomów, a różnice jej składu
chemicznego i stanu fizycznego pochodzą z różnic
wielkości, postaci, liczby i porządku, tworzących
ją atomów.
Teoria atomistyczna uznawana była przez wielkich
uczonych epoki odrodzenia, jednak odkrycia fizyków
i chemików dziewiętnastego wieku stworzyły z koncepcji
filozoficznej - podstawy współczesnej wiedzy o wewnętrznej
budowie materii. Jej zasady były następujące:
- atomy stanowią elementarne, niepodzielne cząstki
materii
- istnieje tyle rodzajów atomów, ile jest pierwiastków
chemicznych, przy czym każdy pierwiastek charakteryzuje
się określoną masą atomową
- związki chemiczne powstają przez połączenie atomów
różnych pierwiastków w prostych stosunkach liczbowych
Jednakże późniejsze badania nie potwierdziły założeń
o niepodzielności atomu i rzuciły światło na jego
budowę wewnętrzną.
- Odkrycie
elektronu - 1897
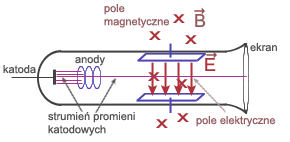
Do doświadczenia Joseph Thomson użył szklanej
rury z umocowaną z jednej strony katodą. Wokół
rury wytworzono pole elektryczne i pole magnetyczne.
.gif)
Pole magnetyczne odchyla cząstki w górę. Tak
dobrano natężenie pola elektrycznego i natężenie
pola magnetycznego, by cząstki poruszały się
bez zmiany kierunku. Siła elektrostatyczna zrównoważyła
się z siłą Lorentza.
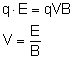
Wyłączono pole elektryczne. Pole magnetyczne
zakrzywiało tor ruchu cząstek. Poruszały się
po łuku, więc siła Lorentza pełniła rolę siły
dośrodkowej.
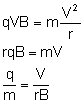
Zamiast prędkości podstawiamy wcześniej wyliczony
iloraz:
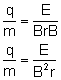
Obliczony stosunek 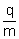 okazał się 1000 razy większy niż taki stosunek
dla jonu wodoru (najmniejszej znanej wówczas
cząstki). Ładunki q obu cząstek były równe,
więc masa cząstek odkrytych przez Thomsona była
ponad 1000 razy mniejsza od masy jonu wodoru.
Te cząstki nazwano elektronami.
okazał się 1000 razy większy niż taki stosunek
dla jonu wodoru (najmniejszej znanej wówczas
cząstki). Ładunki q obu cząstek były równe,
więc masa cząstek odkrytych przez Thomsona była
ponad 1000 razy mniejsza od masy jonu wodoru.
Te cząstki nazwano elektronami.
BUDOWA ATOMU WEDŁUG THOMSONA (model rodzynkowy)
.gif)
Według Thomsona atom był wypełniony substancją
o ładunku dodatnim, a w niej "zanurzone" były
elektronu.
- odkrycie
jądra atomowego - 1911
Ernest Rutherford prowadził doświadczenia, polegające
na bombardowaniu cienkiej folii ze złota cząstkami
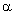 , emitowanymi przez rad. Fizyk zauważył, że
większość cząstek przelatuje prosto przez folię,
niektóre tylko odchylają się o niewielki kąt.
Dalsze doświadczenia pokazały cząstki, które
całkowicie się odbijały.
, emitowanymi przez rad. Fizyk zauważył, że
większość cząstek przelatuje prosto przez folię,
niektóre tylko odchylają się o niewielki kąt.
Dalsze doświadczenia pokazały cząstki, które
całkowicie się odbijały.
Obserwacje te doprowadziły fizyka do wniosku,
iż cały ładunek dodatni atomu skupiony jest
na niewielkich obszarze zwanym jądrem atomowym,
a wokół niego krążą elektrony.
MODEL PLANETARNY BUDOWY ATOMU
.gif)
Taki model budowy atomu kłóci się jednak z zasadami
fizyki klasycznej, gdyż ładunek poruszający
się po linii krzywej emituje promieniowanie,
czyli elektron traciłby energię.
- model
budowy atomu Bohra
POSTULATY BOHRA
I. Elektron krąży wokół jądra po orbicie kołowej,
ale tylko takie orbity są dozwolone, na których
moment pędu elektronu równy jest całkowitej
wielokrotności stałej 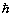 .
.
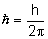
L - moment pędu
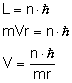
II. Elektron krążąc po dozwolonej orbicie nie
traci energii (nie emituje energii). Energia
wysyłana jest, gdy elektron przeskakuje z wyższej
orbity na niższą.
.gif)
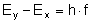
Wyprowadźmy wzór na promień kolejnych orbit.
Siła Coulomba pełni wówczas rolę siły dośrodkowej:
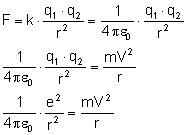
Zamiast prędkości podstawiamy wzór uzyskany
przy I postulacie Bohra:
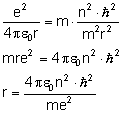
Zamiast stałej 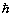 wstawiamy iloraz
wstawiamy iloraz 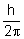 :
:
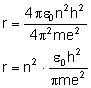
Uzyskaliśmy wzór na promień kolejnych orbit.
Sprawdźmy, jaką energię posiada elektron na
orbicie:
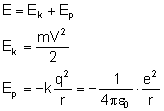
Do wzoru na energię kinetyczną potrzebujemy
znać wartość prędkości, więc wyprowadzamy wzór
na tą wielkość porównując siłę Coulomba z siłą
dośrodkową:
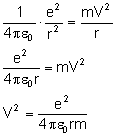
Uzyskaną wartość podstawiamy do wzoru na energię
kinetyczną:
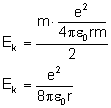
Energia całkowita składa się z energii potencjalnej
i energii kinetycznej:
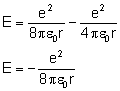
Podstawiamy do wyprowadzenia wcześniej uzyskany
wzór na promień orbity:
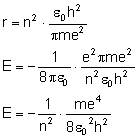
Rozważmy zmianę energii, gdy elektron przeskakuje
z orbity wyższej na niższą:
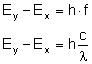
Rozpatrujemy orbity według wcześniej wyprowadzonego
wzoru:
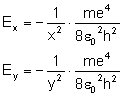
i uzyskujemy:
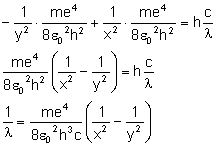
Zamiast iloczynu przed nawiasem wstawiamy stałą
zwaną stałą Rydberga:
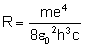
i mamy:
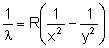
WIDMO ŚWIATŁA WODORU
Bohr analizował promieniowanie emitowane przez
atomy pobudzone bodźcami fizycznymi takimi,
jak: wysoka temperatura lub łuk elektryczny.
Wzbudzone w ten sposób atomy wysyłają promieniowanie,
które można zobaczyć przy pomocy metod analizy
spektroskopowej. Promieniowanie jest charakterystyczne
dla danego rodzaju atomów. Nosi nazwę widma
i składa się z pasm promieniowania o określonej
długości fali, co w świetle widzialnym można
zobaczyć jako oddzielne pasma o różnej barwie.
.gif)
Na podstawie widma atomu wodoru można stwierdzić,
że wzbudzony atom wysyła jedynie pewne długości
światła. Widmo to nie jest ciągłe, jest dyskretne
- przyjmuje jedynie niektóre wartości długości
fal. Bohr dostrzegł, że stosowanie dotychczasowej
teorii elektrodynamiki C. Maxwella nie pozwala
wytłumaczyć nieciągłości widma atomowego. Do
tej pory bowiem, teoria budowy atomu dopuszczała,
by elektrony poruszały się wokół atomu na orbitach
o dowolnych promieniach. Zatem przejście elektronu
z jednej na inną orbitę prowadziłaby do emisji
lub absorpcji promieniowania o dowolnej długości
fali tworząc widmo ciągłe. Dodatkowo, zgodnie
z zasadami klasycznej elektrodynamiki, elektrony
musiałyby tracić energię, co z kolei powodowałoby
zmniejszanie się promienia orbity elektronu
i w efekcie jego spadek na powierzchnię jądra.
Atomy takie musiałyby być nietrwałe.
- falowy
model budowy atomu
Współczesny model budowy atomu bierze pod uwagę
falowe własności cząstek. Z poruszającym się
w atomie elektronem związana jest fala materii
(jest ona falą stojącą). Fala ta jest opisana
tzw. funkcją falową. W związku z tym, że w mechanice
kwantowej nie ma pojęcia toru ruchu, to falowy
model budowy atomu odrzuca pojęcie orbity, możemy
mówić jedynie o prawdopodobieństwie znalezienia
elektronu w danym miejscu.
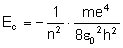
n - główna liczba kwantowa
| Elektron
mając daną wartość energii
może znajdować się w różnych
stanach. Zespół wszystkich
stanów o tej samej energii
nazywa się powłoką elektronową.
|
|
Powłoki są oznaczane, licząc od jądra atomowego,
kolejnymi literami: K, L, M, N, O, P, Q. Największa
liczba elektronów N na pierwszych czterech orbitach
określana jest wzorem:
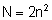
Każdy elektron poruszający się po orbicie w
atomie posiada orbitalny moment pędu L:
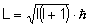
l - orbitalna liczba kwantowa, która przyjmuje
wartości:
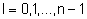
| Zespół
stanów o tej samej orbitalnej
liczbie kwantowej l nazywamy
podpowłoką elektronową. |
|
Podpowłoki oznaczane są małymi literami: s,
p, d, f, g.
Rzutujemy moment pędu na kierunek linii pola
magnetycznego:
.gif)
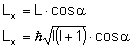
Zrzutowany moment pędu zależy od magnetycznej
liczby kwantowej:
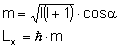
przyjmującej wartości:
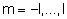
Elektron w atomie posiada dodatkowy moment pędu,
tzw. spin.
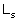 - własny moment pędu
- własny moment pędu
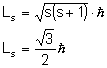
.gif)

Magnetyczna spinowa liczba kwantowa wynosi:
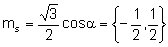
ZASADA PAULLIEGO
| W
atomie nie może być równocześnie
dwóch elektronów w tym samym
stanie kwantowym. |
|
Analiza widmowa
Każdy pierwiastek wysyła charakterystyczne tylko
dla siebie długości promieniowania (odkryli to Kirchhoff
i Bunsen). Analizując dane promieniowanie można
określić jaki pierwiastek to promieniowanie wyemitował.
| Analiza
składu chemicznego danej substancji
na podstawie badania widma, które
ono wysyła nazywa się analizą
widmową. |
|
Do analizy widmowej używany jest spektroskop.
.gif)
Promieniowanie rentgenowskie
Badając wyładowania w gazach rozrzedzonych, niemiecki
fizyk Roentgen odkrył niewidzialne dla oka promieniowanie,
które nazwano
promieniowaniem rentgenowskim
(promieniowaniem X). Jest to promieniowanie elektromagnetyczne
o niewielkiej długości fali, czyli o bardzo dużej
częstotliwości. Powstaje ono w wyniku bombardowania
płytki metalowej strumieniem pędzących z dużą prędkością
elektronów.
Teoria kwantów tłumaczy to zjawisko oddziaływaniem
pola elektrycznego jąder atomów metalu na poruszające
się elektrony, w wyniku czego ulegają one zahamowaniu,
zaś energia hamowania uwalnia się w postaci fotonów
promieniowania rentgenowskiego, zgodnie z zasadą
zachowania energii.
WŁAŚCIWOŚCI PROMIENIOWANIA RENTGENOWSKIEGO
- są
niewidzialne dla oka, lecz naświetlają kliszę
fotograficzną
- rozchodzą
się prostoliniowo oraz podlegają interferencji
i ugięciu
- nie
odchylają się w polu elektrycznym i magnetycznym
- wywołują
jonizację gazów oraz wzbudzają luminescencję
- przenikają
przez wiele materiałów nieprzezroczystych dla
światła, a zwłaszcza przez materiały o niewielkim
ciężarze właściwym
- są
pochłaniane przez inne materiały, zwłaszcza
o dużym ciężarze właściwym, przy czym ilość
pochłoniętego promieniowania jest zależna od
rodzaju materiału i grubości prześwietlanej
warstwy.
Zjawisko Comptona
Korpuskularna natura fal elektromagnetycznych ujawnia
się chyba najpełniej w zjawisku rozpraszania fal
elektromagnetycznych na swobodnych elektronach,
nazywanym
zjawiskiem Comptona. Zjawisko to
polega na zmianie długości fali promieniowania rozproszonego
w porównaniu z długością fali promieniowania padającego.
Najprostszym sposobem zrozumienia tego zjawiska
jest rozpatrzenie zderzenia elektronu z fotonem
jako zdarzenia sprężystego dwóch cząstek, z których
jedna (elektron) początkowo spoczywała. W wyniku
takiego zderzenia foton oddaje elektronowi część
swojej energii i pędu. Energia fotonu rozproszonego
jest więc mniejsza od energii fotonu padającego,
zatem długość fali fotonu rozproszonego powinna
być większa od długości fali fotonu padającego.
Przesunięciem Comptona nazywamy różnicę:
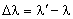
gdzie:
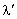
- długość fali fotonu rozproszonego

- długość fali fotonu padającego
Przesunięcie Comptona zależy od kąta rozproszenia:
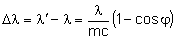
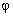
- kąt rozproszenia.
Zasada działania lasera
Pierwszy laser, którego nazwa pochodzi od pierwszych
liter angielskiego zwrotu Light Amplification by
Stimulated Emission of Radiation, co w polskim tłumaczeniu
brzmi "Wzmocnienie światła przez wymuszoną emisję
promieniowania" zbudowany został dopiero w 1960
roku przez T. Maimana.
Działanie lasera opiera się na dwóch zjawiskach:
inwersji obsadzeń i emisji wymuszonej.
Emisja wymuszona zachodzi, gdy atom wzbudzony
zderza się z fotonem o takiej częstotliwości, że
jego energia kwantu jest równa różnicy energii poziomów
między stanem wzbudzonym a podstawowym. Foton uderzający
nie ulega pochłonięciu, ale przyspiesza przejście
atomu ze stanu wzbudzonego do podstawowego i dlatego
z atomu wylatują w tym samym kierunku dwa spójne,
to znaczy zgodne w fazie fotony o tej samej energii,
więc i częstotliwości.
Aby mogła zachodzić w dużych ilościach emisja wymuszona
należy w ośrodku wzmacniającym stworzyć odpowiednie
warunki (spowodować, by więcej elektronów było w
stanie wzbudzonym niż w stanie podstawowym). Taki
proces nosi nazwę
inwersji obsadzeń (odwrócenia
obsadzeń). Odwrócenie obsadzeń uzyskuje się za pomocą
oświetlenia światłem (pompowanie optyczne), innym
laserem, światłem błyskowym, wyładowaniem prądu
w gazach, reakcjami chemicznymi albo wykorzystując
rekombinację w półprzewodnikach.
Poziom metastabilny jest to poziom wzbudzony,
na którym czas przebywania elektronu jest dostatecznie
długi by zaszła inwersja obsadzeń.
Wzmacniacz laserowy zamienia się w generator,
gdy ośrodek wzmacniający zostanie umieszczony w
rezonatorze. Wówczas promieniowanie wprowadzone
wzdłuż osi rezonatora odbija się od zwierciadła
umieszczonego na jednym końcu rezonatora oraz od
półprzeźroczystego zwierciadła na drugim końcu.
Pomiędzy zwierciadłami fale są wzmacniane wskutek
emisji wymuszonej. Promieniowanie wychodzi z rezonatora
przez półprzeźroczyste zwierciadło w postaci spójnej,
monochromatycznej, równoległej wiązki światła o
dużej mocy. Emitowana wiązka jest doskonale równoległa,
bowiem fale, które nie wędrują tam i z powrotem
między zwierciadłami, szybko uciekają na boki ośrodka
drgającego bez wzmocnienia.
.gif)
Rodzaje laserów:
- rubinowy
(ma pręt ze sztucznego rubinu, emituje czerwone
światło)
- gazowy
- półprzewodnikowy
(dł. ok. 1mm; mała moc; wiązka na ogół nie jest
skupiona)
- jonowy
- molekularny
- barwnikowy
- chemiczny
Lasery znalazły wiele zastosowań; są na przykład
używane do spawania, w medycynie np. chirurgii,
holografii, drukarkach, telekomunikacji optycznej
oraz do odczytywania Informacji cyfrowej.