|
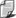 Atom
wodoru wg. Bohra
Atom
wodoru wg. Bohra
1.
Postulaty Bohra
W
roku 1911 Rutherford odkrył istnienie jądra atomu.
W dwa lata później Niels Bohr udoskonalił model Rutherforda
i w ten sposób powstał model atomu wodoru .
Według Bohra atom wodoru ma dodatnie jądro o ładunku
+ e , wokół którego po orbicie kołowej porusza się
elektron o ładunku - e .
Postulaty Bohra:
•
Kiedy elekton krąży po jednej z dozwolonych orbit
i nie promieniuje energii w postaci fal elektromagnetycznych.
Energia jest emitowana podczas przeskoku elektronu
z jednej z dozwolonych orbit na inną.
•
Dla elektronu krążącego wokół jądra dozwolone są tylko
takie orbity, dla których moment pędu, zwany inaczej
krętem (będący iloczynem pędu elektronu i promienia
orbity , po której krąży), jest całkowitą wielokrotnością
stałej Plancka podzielonej przez 2? .
2.
Promienie orbit dozwolonych
Promienie
orbit dozwolonych znajdujemy z układu równań:
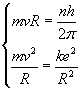
Pierwszy
wzór to postulat Bohra, o którym była mowa w paragrafie
pierwszym.
Drugi wzór mówi nam, że siła dośrodkowa działająca
na elektron jest siłą przyciągania kulombowskiego
między jądrem a elektronem.
Redukujemy nasz układ równań:
Po
podzieleniu stronami, otrzymujemy...
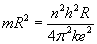
...i
ostatecznie:
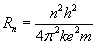
Dla
przykładu:
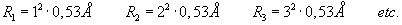
Angstrem
( A "z kółeczkiem") to jednostka długości,
służąca do mierzenia rozmiarów porównywalnych z rozmiarem
atomu.
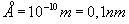
Na
sam koniec podaję oznaczenia poszczególnych składowych
wzoru na promienie orbit dozwolonych:
R n --> promień n -tej orbity
dozwolonej atomu,
h --> stała Plancka,
m --> masa elektronu,
k --> współczynnik proporcjonalności zależący od
środowiska, w którym znajdują się ładunki,
e --> elektron.
Wartości: h, m, k, e są stałe,a więc wartość promienia
orbity dozwolonej zależy tylko od n . Promień pierwszej
orbity określa rozmiary atomu wodoru w stanie podstawowym.
3.
Energie dozwolone
Elektron
krążący po orbicie kołowej wokół jądra ma energię
kinetyczną i potencjalną kulombowską. Jego całkowita
energia, a więc energia atomu wodoru, jest sumą tych
dwu energii.
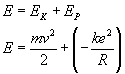
Wiemy,
że (patrz paragraf 2 - drugie równanie układu równań):
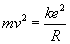
Zatem:
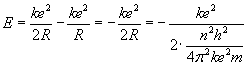
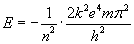
Podstawiając
pod odpowiednie stałe ich wartości, otrzymamy...
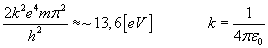
Można
więc zapisać:
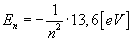
Dla
przykładu:
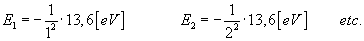
Ze
wzorów tych widzimy, że energia atomu wodoru może
przyjmować jedynie pewne ściśle określone wartości.
Najmniejszą wartość ma energia na pierwszej orbicie.
Wtedy atom jest w tzw. stanie podstawowym .
4.
Promieniowanie atomu wodoru
Przejście
ze stanu energii N na stan energii M prowadzi do wypromieniowania
przez atom kwantu energii o wartości:
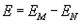
Jak
już wiemy z poprzedniego tematu, energia E kwantu
energii jest równa:
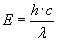
Tak
więc liczymy...
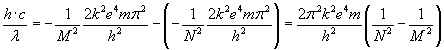
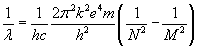
Stała
Rydberga ( R ) wyrażana jest następującym wzorem:
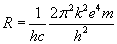
Możemy
zapisać ostateczny wzór:
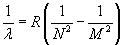
Powyższe
wyrażenie opisuje zbiór długości fal wysyłanych przez
wzbudzony atom wodoru, czyli widmo promieniowania
wodoru .
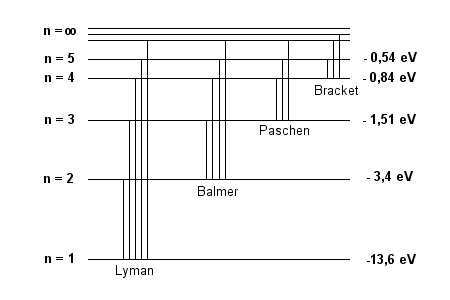
Serię Lymana tworzą fotony przeskakujące na orbitę
N = 1 z orbit wyższych (są to fotony o częstotliwościach
z dalekiego nadfioletu). Serię Balmera - fotony przeskakujące
na orbitę N = 2 z wyższych, przy czym cztery pierwsze
linie serii Balmera, tzw linie H ?
, H ? , H ? ,
H ? odpowiadają fotonom światła
widzialnego. Dalszym seriom (leżącym w podczerwieni)
odpowiadają przeskoki z wyższych orbit na trzecią,
czwartą itd. (patrz rysunek)
5.
Prędkości dozwolone
Do
wyliczania prędkości dozwolonych będziemy wykorzystywać
zależność siły dośrodkowej i kolumbowskiej, o której
mowa była wyżej.
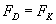
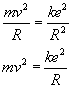
Ponieważ...
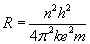
...to:
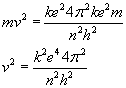
I
ostatecznie:
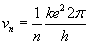
Dla
przykładu:
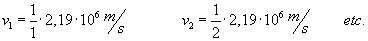
|