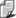 Dlaczego góra lodowa pływa w wodzie?
Dlaczego góra lodowa pływa w wodzie?
Gdyby lód nie pływał w wodzie, lecz tonął, tak jak dzieje się w przypadku większości ciał stałych, które toną w swoich cieczach, Titanic z pewnością nie zderzyłby się z górą lodową. Ale woda jest dla nas i organizmów żywych bezcenna, ma więc wyjątkowe właściwości.
Przyczyną tego, że ciała stałe toną w cieczach jest rozszerzalność cieplna ciał. Większość substancji w miarę ogrzewania rozszerza się, bo rosną odległości między cząsteczkami - rośnie średnia szybkość ruchu cząsteczek - i objętość takiego ciała rośnie. Powoduje to zmniejszenie gęstości w miarę wzrostu temperatury.
Ponieważ lód zachowuje się inaczej (topiąc się zmniejsza swoją objętość), po odpowiedź dlaczego tak się dzieje trzeba "wejść" do świata cząsteczek i atomów.
Cząsteczka wody o wzorze H2O jest zbudowana z jednego atomu tlenu i dwóch atomów wodoru. Ponieważ atom tlenu jest silnie elektroujemny, ładunek par elektronowych, wiążących atom tlenu z dwoma atomami wodoru, grupuje się w pobliżu jądra atomu tlenu. W pobliżu jąder wodorów (protonów) cząsteczka wody wykazuje więc wypadkowy ładunek dodatni, w pobliżu jądra tlenu - wypadkowy ładunek ujemny. Takie rozłożenie ładunków sprawia, że cząsteczka wody jest dipolem (rys.1).
Rys.1.
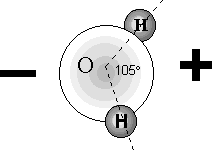
W ciekłym stanie skupienia cząsteczki wody poruszają się bezustannie i chaotycznie, ale "trzymają się" razem, gdyż przyciągają się wzajemnie i dzięki temu woda zachowuje spoistość, nie rozpada się samorzutnie. Rys.2. przedstawia model wody, choć nie oddaje on oczywiście nieustannego ruchu cząsteczek.
Rys.2.
W stanie stałym siły przyciągania między cząsteczkami są bardzo duże. Cząsteczki mogą jedynie drgać wokół położeń równowagi w węzłach sieci krystalicznej.
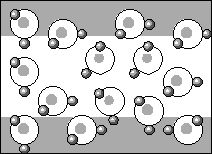
Sieć krystaliczna lodu tworzy się poprzez tzw. wiązania wodorowe - dwa atomy wodoru każdej cząsteczki wody tworzą wiązania z dwoma innymi cząsteczkami wody wskutek elektrostatycznego przyciągania. W rezultacie każdy atom tlenu tworzy jakby cztery wiązania z atomami wodoru, przy czym dwa atomy wodoru wchodzą w skład danej cząsteczki wody, a dwa pozostałe pochodzą od sąsiednich cząsteczek. Te cztery wiązania są ułożone w przestrzeni tak, że atom tlenu znajduje się w środku czworościanu foremnego, a atomy wodoru w jego narożach (rys.3.).
Rys.3.
Takie ustawienie jest spowodowane tym, że atomy wodoru starają się być jak najbliżej atomu tlenu (występuje przyciąganie), a jednocześnie chcą być jak najdalej od siebie (odpychanie). Konsekwencją takiego łączenia się cząsteczek wody jest powstanie sieci krystalicznej o ażurowej strukturze (rys.4.), przypominającej tunele. A więc sieć krystaliczna lodu zawiera wiele pustych miejsc i właśnie one decydują o zmianie gęstości w czasie topnienia. Warto wspomnieć, że charakterystyczną symetrię sześciokątną ustawienia cząsteczek obserwujemy na zewnątrz w pojedynczych płatkach śniegu.
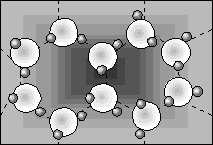
Rys.4.
W czasie ogrzewania lodu drgania cząsteczek zwiększają się, aż w trakcie topnienia (0°C) dochodzi do zrywania wiązań wodorowych, struktura zaczyna rozpadać się - lód zmienia się w wodę. Uwolnione cząsteczki mogą wepchnąć się w puste miejsca, powoduje to zmniejszenie objętości, a tym samym zwiększenie gęstości.
Lód pływa więc w wodzie, ponieważ jego gęstość jest mniejsza od gęstości wody.
Pozostańmy jeszcze przy ogrzewaniu wody, aż do momentu, gdy przestanie zachowywać się wyjątkowo. Przy wzroście temperatury od 0°C do 4°C gęstość wody dalej rośnie. Dlaczego tak się dzieje?
W temperaturze topnienia nie zostają zerwane wszystkie wiązania wodorowe, a więc w wodzie istnieją jeszcze resztki tuneli, które stopniowo rozpadają się, aż do temperatury 4°C, w której gęstość wody osiąga największą wartość. Przy dalszym ogrzaniu woda zachowuje się już normalnie, tak jak inne ciecze zwiększa swoją objętość, bo bezładne ruchy cząsteczek w miarę dostarczania energii nasilają się, rosną odległości i w efekcie gęstość wody zaczyna maleć.
Takie anomalne właściwości wody powodują, że w zimie tuż pod lodem woda ma temperaturę 0°C, a na dnie głębokiego zbiornika zbiera się woda o temperaturze 4°C, ponieważ tonie w wodzie o mniejszej gęstości.
Literatura:
1. R. P. Feynman - "Sześć łatwych kawałków", Prószyński i spółka, Warszawa 1998
2. A. Januszajtis, J. Kalinowski - "Molekularna budowa ciał", WSiP, Warszawa 1988
3. G. Francuz-Ornat, T. Kulawik, M. Nowotny- Różańska - "Mechanika i ciepło", podręcznik dla gimnazjum, Nowa Era, Warszawa 2000 |