Zadanie konkursowe.
Zadanie
Zadanie. Częstotliwość fali światła. Kamil Jurowski.
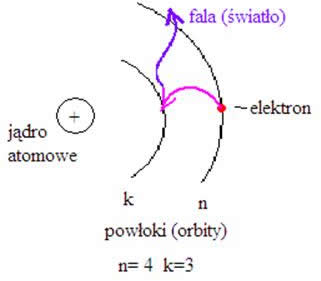
Według teorii Bohra atom wodoru składa się z dodatnio naładowanego jądra (protonu) i krążącego wokół niego elektronu. Elektron taki w stanie podstawowym ma energię równą -13,6 eV.
Oblicz, jaką częstotliwość ma fala emitowana przez inny atom przy przejściu elektronu z orbity czwartej na trzecią. Wiedząc, że fala świetlna to fala elektromagnetyczna rozchodząca
się z prędkością światła
![]() ,
,
a stała Placka wynosi
![]() .
.
Rozwiązanie
Dane
Szukane
Tj=?
Rozwiązanie
Aby obliczyć kwant energii światła należy skorzystać ze wzoru:
![]()
gdzie:
h - stała Plancka
![]()
![]() -
częstotliwość fali,
-
częstotliwość fali,
Energia ta będzie równa różnicy energii jakie posiada elektron na poszczególnych orbitach
![]()
gdzie:
![]() -
energia elektronu na dalszej powłoce (dalej od jądra atomowego)
-
energia elektronu na dalszej powłoce (dalej od jądra atomowego)
![]() -
energia elektronu na bliższej powłoce (bliżej jądra atomowego)
-
energia elektronu na bliższej powłoce (bliżej jądra atomowego)
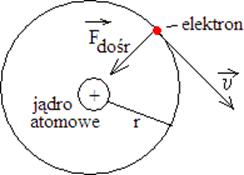
Schematyczny rysunek:
![]() (1.1)
(1.1)
Energia elektronu to energia kinetyczna + energia potencjalna:
![]()
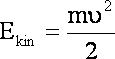
![]()
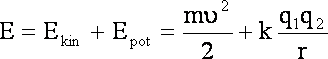
Ponieważ ![]() i
po wstawieniu k do licznika stąd:
i
po wstawieniu k do licznika stąd:
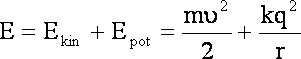
Wartość q dotyczy elektronu a wiec ładunku elementarnego e. Związku z tym, że założenia dotyczą elektronu, który ma ładunek ujemny, wartość członu określającego energię potencjalną będzie zawierał znak minus.
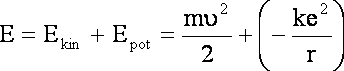 (1.2)
(1.2)
z kolej po porównaniu F dośrodkowej krążącego elektronu z jego siłą elektrostatyczną:
![]()
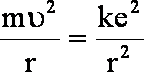
po podzieleniu obu stron przez r
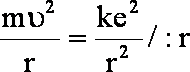
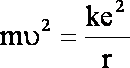 (1.3)
(1.3)
Wartości (1.3) do (1.2), otrzymujemy:
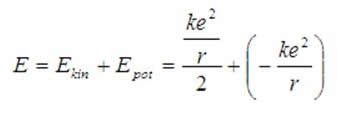
Po zmianie znaków:
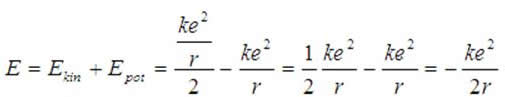
Otrzymujemy:
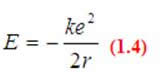
Z pierwszego warunku Bohra:
,,Moment pędu elektronu musi być równy wielokrotności
stałej Plancka przez ![]() ".
".
Co można zapisać:
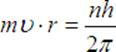
Po przekształceniu
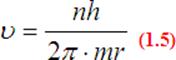
Po porównaniu siły dośrodkowej działającej na elektron i siły elektrostatycznej
![]()
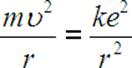
Po podstawieniu za v równania 1.5, otrzymujemy:
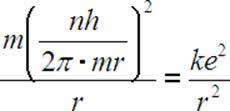
Po pomnożeniu na krzyż:
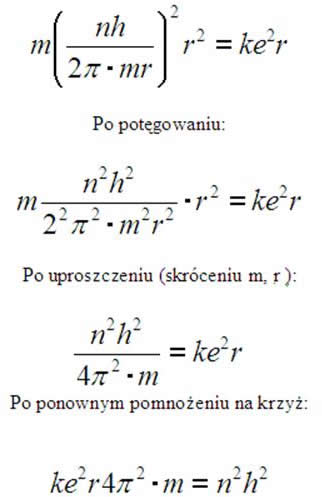
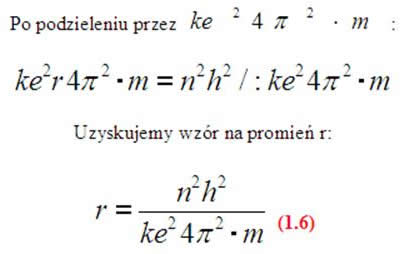
Łatwo zauważyć, że n to numer powłoki, jeżeli podstawilibyśmy liczbę 1, to uzyskalibyśmy wartość promienia atomu wodoru (ponieważ ma jedną orbitę- jeden krążący elektron wokół jądra).
Stąd wartość promienia atomu wodoru:
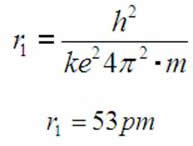
Podstawiając do wzoru (1.6) wartość:
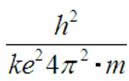
jako ![]() uzyskujemy:
uzyskujemy:
![]() (1.7)
(1.7)
Podstawiając wzór (1.7) do wzoru (1.4)
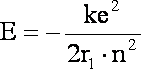
Ponownie łatwo zauważyć, że podstawiając ża n=1 uzyskamy tym razem wartość energii dla pierwszej orbity, stan podstawowy atomu wodoru, wiec można wyrażenie:
![]()
zastąpić symbolem
![]()
jako energia stanu podstawowego:
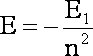 (1.8)
(1.8)
Po żmudnych, ale niezbędnych obliczeniach dotarliśmy do upragnionej wartości na energię elektronu na różnych orbitach, jednak to nie koniec naszej przygody z przekształceniami wzorów....
Wracając do naszego wzoru (1.1):
![]()
za
![]()
i za
![]()
podstawiamy wyrażenie (1.8) odpowiednio zmieniając oznaczenia energii dla poszczególnych orbit:
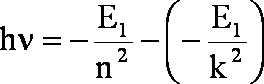
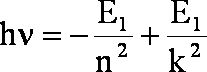
po wyciągnięciu E1 przed nawias i uporządkowaniu wyrazów:
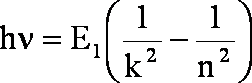
Po podzieleniu przez h:
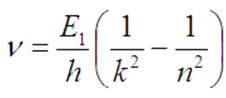 (1.9)
(1.9)
Ponieważ ![]()
Po przekształceniu na ![]() :
:
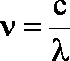 (1.10)
(1.10)
Po podstawieniu wzoru (1.10) do wzoru (1.9)
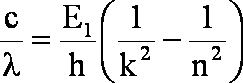
po podzieleniu przez c:
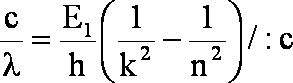
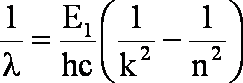
Warto wiedzieć, że wartość ![]() to
stała Rydberga
to
stała Rydberga
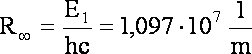
Po zastąpieniu tego członu stałą Rydberga uzyskujemy upragniony wzór Balmera:
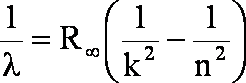
Stąd możemy obliczyć długość fali
Dane:
n = 4,
k = 3
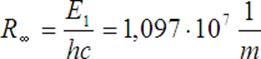
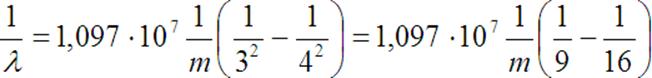
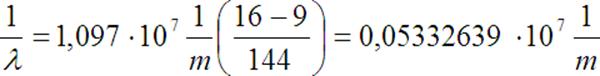
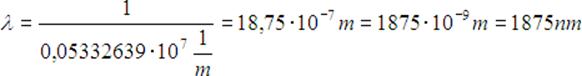
![]()
Korzystając znowu ze wzoru (1.10)
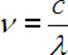
Wyliczamy częstotliwość
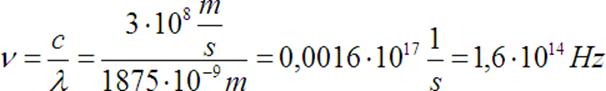
Odpowiedź
Częstotliwość fali światła pochodzącej z emisji atomu przy przejściu elektronu
z orbity czwartej na trzecią wynosi
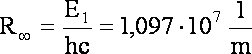 .
.
Dyskusja
Podstawa teoretyczna
Artykuły na stronie
Linki
...